A conformidade dos fios metálicos maleáveis para a fixação cirúrgica
Redação
Estes fios se destinam a serem manuseados e conformados pelo cirurgião para promover processos de fixações cirúrgicas, como cerclagens de órgãos ou de extremidades de ossos fraturados. Deve-se entender os requisitos químicos, mecânicos e dimensionais para fios metálicos maleáveis destinados à fixação cirúrgica.
Os fios metálicos maleáveis para fixação cirúrgica são implantes com emprego em diversas áreas cirúrgicas, conformados mecanicamente por processamento a frio, como trefilação, cujo material pode ser adquirido em suas geometrias finais ou processados pelo fabricante de implante para atingirem as especificações dimensionais desejadas. Estes fios se destinam a serem manuseados e conformados pelo cirurgião para promover processos de fixações cirúrgicas, como cerclagens de órgãos ou de extremidades de ossos fraturados.
Se por um lado demandam resistência mecânica mínima à tração para assegurar a fixação desejada, limites máximos precisam também ser estabelecidos para possibilitar o manuseio apropriado pelo cirurgião para promover esta fixação. Para estas aplicações cirúrgicas, é essencial que o fio possa ser torcido ou amarrado na forma de nó sem fraturar ou desenvolver trincas ou fissuras na sua superfície.
Esta norma descrita abaixo estabelece requisitos mínimos para a segurança e a eficácia destes produtos para a saúde. Embora nenhum material para implante cirúrgico mostre ser completamente livre de reações adversas no corpo humano, as ligas indicadas têm sido empregadas com sucesso, por mais de uma década, na fabricação de fios metálicos maleáveis para uso cirúrgico em seres humanos em aplicações onde ocorre o contato do implante com ossos e tecidos moles, e experiências clínicas prolongadas do emprego deste material mostram que um nível aceitável de resposta biológica pode ser esperado quando o material é usado em aplicações apropriadas.
Os fios maleáveis podem ser usados em conjunto com outros implantes. Nestas circunstâncias, é importante que fios de aço inoxidável de acordo com a NBR ISO 5832-1 e com a NBR ISO 5832-9 (alto nitrogênio) sejam somente destinados a serem usados em conjunto com os implantes feitos do aço inoxidável correspondente. Isto reduz a possibilidade de ocorrência de corrosão galvânica entre o implante e os fios.
Embora possam ser caracterizadas como fios metálicos maleáveis, esta norma não abrange suturas metálicas, cujos requisitos podem ser encontrados nas NBR ISO 10334 e NBR 13904. Os requisitos estabelecidos na NBR 10334 para fios maleáveis para uso como suturas e outras aplicações cirúrgicas estão abrangidos por esta norma. Igualmente, o uso dos fios metálicos, muitas vezes denominados fios de Kirschner, é um método de fixação simples e eficaz para a correção de fraturas e luxações do ombro na cirurgia ortopédica. Uma das possíveis complicações é a migração do fio durante o acompanhamento pós-operatório.
A NBR 16203 de 08/2019 - Implantes para cirurgia — Fios metálicos maleáveis para fixação cirúrgica — Requisitos estabelece requisitos químicos, mecânicos e dimensionais para fios metálicos maleáveis destinados à fixação cirúrgica. Os implantes devem ser produzidos de acordo com os materiais a seguir: aço inoxidável conformado, conforme a NBR ISO 5832-1 ou a ASTM F138; titânio puro, conforme a NBR ISO 5832-2 ou a ASTM F67; aço inoxidável conformado de alto nitrogênio, conforme a NBR ISO 5832-9 ou a ASTM F1586; ou liga conformada de cobalto-cromo-tungstênio-níquel, conforme a NBR ISO 5832-5 ou a ASTM F90. As tabelas abaixo apresentam as tolerâncias aceitáveis para as análises de elementos em aços, titânio não ligado e ligas de titânio e de cromo.
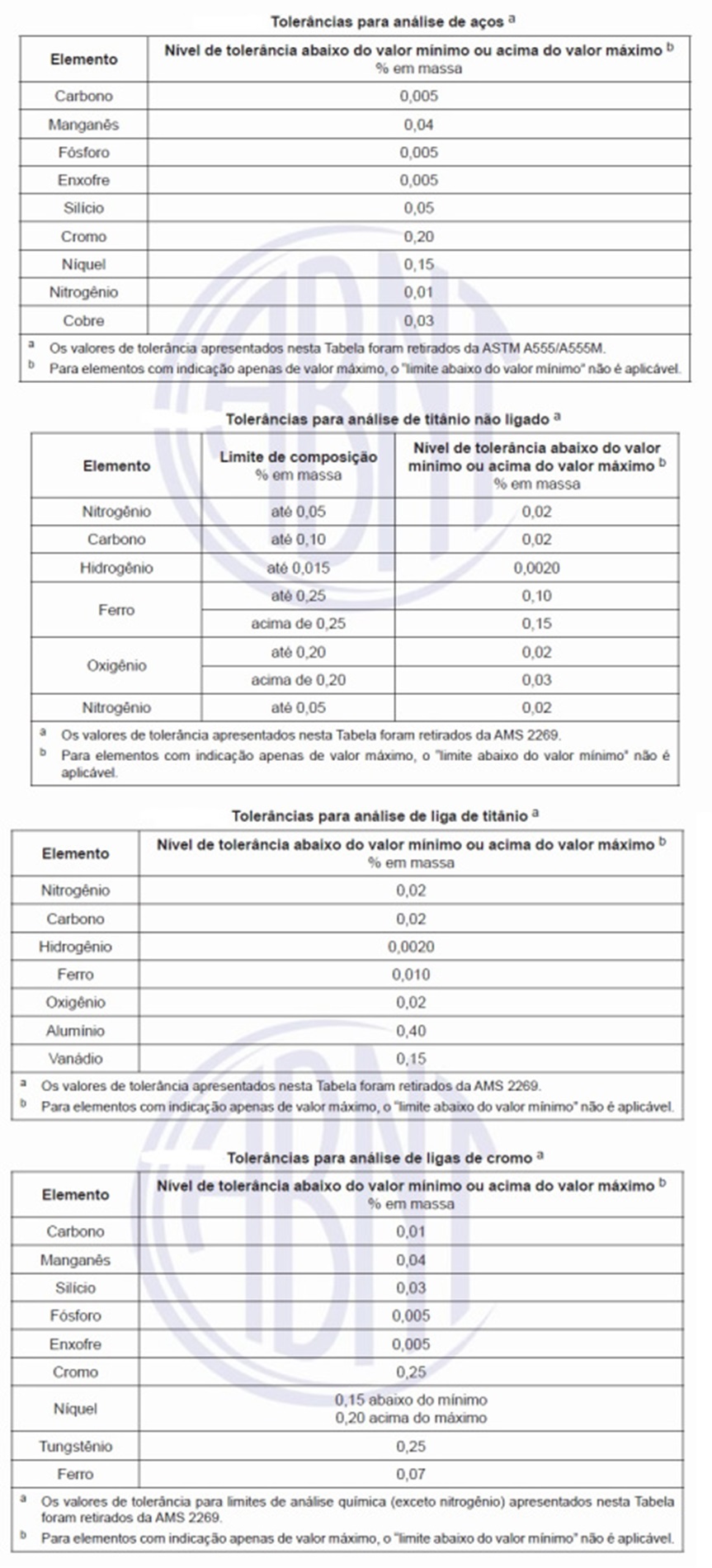
As tolerâncias para análise não ampliam os requisitos especificados para a análise do material do implante, mas abrangem as variações entre laboratórios na determinação da composição química. A tolerância de análise é uma variação permissível acima do limite máximo e abaixo do limite mínimo de um elemento especificado e aplicável apenas à análise do material adquirido, mas não às análises de panela e de lingote (ASTM A751). As tolerâncias para análise do material adquirido são baseadas em capacidades analíticas que foram demonstradas para esta composição e aceitos como aqueles associados aos fabricantes de metais.
O termo tolerância de análise é frequentemente mal interpretado e não se aplica a análises de panela para demonstrar conformidade com limites químicos especificados. Aplica-se apenas a análise do material a ser adquirido (produto metalúrgico), e é significativo quando a análise de panela de um elemento está próxima ao seu limite especificado. Exemplo: os limites para Cr no aço inoxidável UNS 30400 variam entre 18,0% e 20,0%.
Uma análise de panela que o fabricante do aço indique como 18,01 % de Cr pode apresentar um valor de 17,80 % de Cr por uma análise realizada pelo fabricante de implante. Se a tolerância para análise do material neste nível de Cr for 0,20 %, um resultado do teor Cr de até 17,80 %, na análise realizada pelo fabricante de implante, na amostragem de recebimento, pode ser considerado como aceitável.
O fabricante de implante deve considerar que, junto com as informações dos limites de composição e respectivas tolerâncias estabelecidas, é necessário que sejam conhecidas as incertezas dos procedimentos de análise química empregados para a determinação da composição do material adquirido, a fim de serem definidos os valores de controle empregados para o recebimento das suas matérias-primas. A análise de um material adquirido fora das tolerâncias estabelecidas nas tabelas acima deve levar à rejeição do lote de material para a fabricação do implante.
No entanto, a critério do fabricante de implante, uma análise extra pode ser utilizada, desde que uma justificativa seja estabelecida e registrada para o caso de aceitação do lote de material. O implante deve ser fabricado por um processo de estiramento a frio ou de conformação a frio. Não são permitidas soldas.
Se um aquecimento local for necessário para reconformar pontos em produtos fabricados em aço inoxidável, isto só deve ser realizado se todo o produto final satisfizer ao ensaio de corrosão intergranular de acordo com a ISO 3651-2. Os componentes, estirados ou conformados a frio, fornecidos por terceiros para a fabricação do implante devem atender aos requisitos estabelecidos na Seção 6.
O fabricante do implante deve requerer que o componente manufaturado por terceiros seja fornecido com os seguintes documentos: uma declaração de que o componente foi manufaturado e ensaiado, atendendo a todos os requisitos da Seção 6; e b) um relatório completo dos resultados das avaliações requeridas na Seção 6. A embalagem e as condições de manuseio e transporte para o fornecimento de componentes manufaturados por terceiros devem ser estabelecidas pelo fabricante do implante no plano de manufatura.
Os procedimentos para a embalagem comercial de produtos são estabelecidos na NBR 16465. A superfície do implante deve ser processada para minimizar imperfeições, como marcas de ferramentas, cortes, arranhões, trincas, cavidades, esporas e outros defeitos que possam prejudicar a segurança e a eficácia do fio. O fio deve ser submetido a um processo de passivação, conforme especificado na NBR 12932.
A menos que especificado de outra forma em projeto, o implante deve ser fornecido no estado recozido brilhante. Outro acabamento superficial estabelecido pelo fabricante de implante deve ser especificado nas informações fornecidas pelo fabricante. O implante deve ser fornecido limpo.
A condição de limpeza deve estar estabelecida e o processo de limpeza validado. A NBR 16466 apresenta procedimentos para a avaliação de resíduos de limpeza em implantes para cirurgia. A NBR 16467 apresenta requisitos para a limpeza e para a validação do processo de limpeza de implantes ortopédicos que podem ser úteis para as avaliações requeridas para a limpeza de fios metálicos de fixação cirúrgica.
Os implantes devem ser manuseados com cuidado e adequadamente embalados para prevenção de danos e preservação da condição de limpeza. O fabricante deve estabelecer um plano de amostragem que assegure que o lote do produto liberado para comercialização atenda aos requisitos desta norma. Sempre que pertinente, as avaliações requeridas devem ser conduzidas em amostras de ensaio constituídas por componentes acabados.
A menos que estabelecido e justificado de outra forma pelo projeto do implante, após a limpeza em processo, todo implante deve ser submetido à inspeção visual para a avaliação das características superficiais. Outros métodos de inspeção podem ser necessários, em função de potenciais impactos das etapas prévias de processamento sobre as características superficiais do implante. A menos que especificado de outra forma, os ensaios para avaliação de requisitos dimensionais e mecânicos devem ser conduzidos em amostras constituídas por pelo menos dez espécimes do dispositivo acabado.

Hayrton Rodrigues do Prado Filho



















